Kit de diagnóstico de insulina para el control de la diabetes
Kit de diagnóstico para insulina
Metodología: ensayo inmunocromatográfico de fluorescencia
Información de producción
| Número de modelo | EN S | Embalaje | 25 pruebas/kit, 30kits/CTN |
| Nombre | Kit de diagnóstico para insulina | Clasificación de instrumentos | Clase II |
| Características | Alta sensibilidad, fácil operación | Certificado | CE/ISO13485 |
| Exactitud | > 99% | Duración | Dos años |
| Metodología | Ensayo inmunocromatográfico de fluorescencia | Servicio OEM/ODM | Disponible |
Superioridad
Tiempo de prueba: 10-15 minutos
Almacenamiento: 2-30 ℃/36-86 ℉
Metodología: ensayo inmunocromatográfico de fluorescencia
Característica:
• Alta sensibilidad
• lectura de resultados en 15 minutos
• Operación fácil
• Alta precisión

USO PREVISTO
Este kit es adecuado para la determinación cuantitativa in vitro de los niveles de insulina (INS) en muestras de suero/plasma/sangre total humana para la evaluación de la función de las células β de los islotes pancreáticos.Este kit solo proporciona resultados de la prueba de insulina (INS) y el resultado obtenido se analizará en combinación con otra información clínica.El resultado se analizará en combinación con otra información clínica.
Procedimiento de prueba
| 1 | Antes de usar el reactivo, lea atentamente el prospecto y familiarícese con los procedimientos operativos. |
| 2 | Seleccione el modo de prueba estándar del analizador inmunológico portátil WIZ-A101 |
| 3 | Abra el paquete de reactivo en bolsa de papel de aluminio y saque el dispositivo de prueba. |
| 4 | Inserte horizontalmente el dispositivo de prueba en la ranura del analizador inmunológico. |
| 5 | En la página de inicio de la interfaz de operación del analizador inmunológico, haga clic en "Estándar" para ingresar a la interfaz de prueba. |
| 6 | Haga clic en "QC Scan" para escanear el código QR en el lado interior del kit;introduzca los parámetros relacionados con el kit en el instrumento y seleccione el tipo de muestra. Nota: Cada número de lote del kit se escaneará una vez.Si se ha escaneado el número de lote, omita este paso. |
| 7 | Verifique la coherencia del “Nombre del producto”, el “Número de lote”, etc. en la interfaz de prueba con la información de la etiqueta del kit. |
| 8 | Retire el diluyente de la muestra cuando la información sea consistente, agregue 10 μl de muestra de suero/plasma/sangre total y mezcle bien; |
| 9 | Agregue 80 µl de la solución bien mezclada anteriormente mencionada al pocillo del dispositivo de prueba; |
| 10 | Después de completar la adición de la muestra, haga clic en "Tiempo" y el tiempo de prueba restante se mostrará automáticamente en la interfaz. |
| 11 | El analizador inmunológico completará automáticamente la prueba y el análisis cuando llegue el momento de la prueba. |
| 12 | Una vez completada la prueba mediante el analizador inmunológico, el resultado de la prueba se mostrará en la interfaz de prueba o se podrá ver a través del "Historial" en la página de inicio de la interfaz de operación. |
Nota: cada muestra se pipeteará con una pipeta limpia y desechable para evitar la contaminación cruzada.
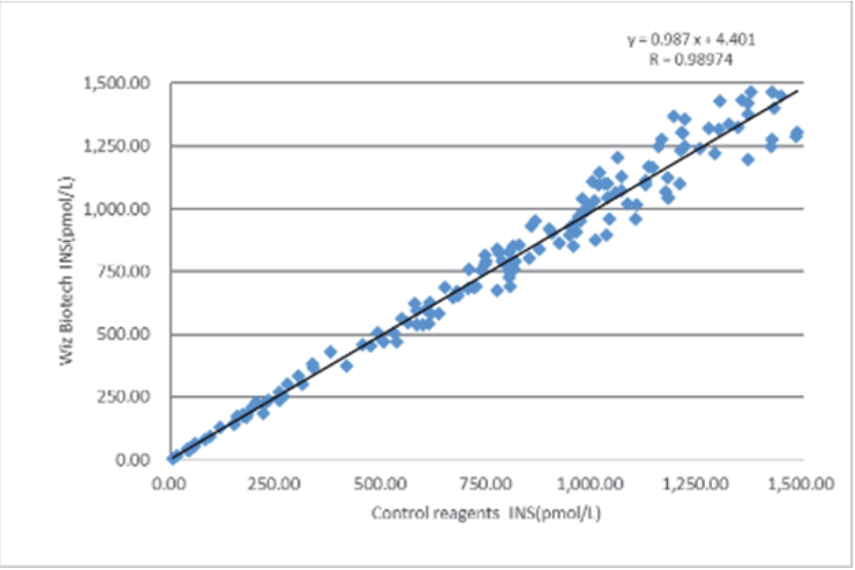
Rendimiento clínico
El desempeño de la evaluación clínica de este producto se evaluó mediante la recolección de 173 muestras clínicas.Los resultados de las pruebas se compararon utilizando los kits correspondientes del método de electroquimioluminiscencia comercializado como reactivos de referencia, y se investigó su comparabilidad mediante regresión lineal, y los coeficientes de correlación de las dos pruebas fueron y = 0,987x+4,401 y R = 0,9874, respectivamente. .