Diagnostická sada pro protilátku proti viru hepatitidy C (fluorescenční imunochromatografický test)
Pouze pro diagnostické použití in vitro
Před použitím si pozorně přečtěte tento příbalový leták a přesně dodržujte pokyny.Spolehlivost výsledků testu nemůže být zaručena, pokud existují odchylky od pokynů v tomto příbalovém letáku.
ZAMÝŠLENÉ POUŽITÍ
Diagnostická sada pro protilátku proti viru hepatitidy C (fluorescenční imunochromatografický test) je fluorescenční imunochromatografický test pro kvantitativní detekci HCV protilátky v lidském séru nebo plazmě, což je důležitá pomocná diagnostická hodnota pro infekci hepatitidou C. Všechny pozitivní vzorky musí být potvrzeny jinými metodiky.Tento test je určen pouze pro použití ve zdravotnictví
1.Všechny reagencie a vzorky odložte na pokojovou teplotu.
2. Otevřete Portable Immune Analyzer (WIZ-A101), zadejte přihlašovací heslo účtu podle způsobu ovládání přístroje a vstupte do rozhraní detekce.
3. Naskenujte identifikační kód pro potvrzení testovaného předmětu.
4. Vyjměte testovací kartu z fóliového sáčku.
5. Vložte testovací kartu do slotu pro kartu, naskenujte QR kód a určete testovaný předmět.
6. Přidejte 20 μl vzorku séra nebo plazmy do roztoku na ředění vzorků a dobře promíchejte.
7. Přidejte 80 μl roztoku vzorku do jamky na kartu.
8. Klikněte na tlačítko „standardní test“, po 15 minutách přístroj automaticky detekuje testovací kartu, může načíst výsledky z obrazovky přístroje a zaznamenat/vytisknout výsledky testu.
9. Viz pokyny k přenosnému imunitnímu analyzátoru (WIZ-A101).
SOUHRN
Virus hepatitidy C (HCV) je obalový, jednořetězcový virus pozitivní sense RNA (9,5 kb) patřící do čeledi Flaviviridae.Bylo identifikováno šest hlavních genotypů a série podtypů HCV.HCV izolovaný v roce 1989 je nyní považován za hlavní příčinu hepatitidy non-A, non-B spojené s transfuzí.Onemocnění je charakterizováno akutní a chronickou formou.U více než 50 % infikovaných jedinců se vyvine závažná, život ohrožující chronická hepatitida s cirhózou jater a hepatocelulárními karcinomy.Od zavedení anti-HCV screeningu dárců krve v roce 1990 se výskyt této infekce u příjemců transfuze výrazně snížil.Klinické studie ukazují, že u významného množství jedinců infikovaných HCV se vyvinou protilátky proti nestrukturálnímu proteinu NS5 viru.Za tímto účelem testy zahrnují antigeny z oblasti NS5 virového genomu kromě NS3 (c200), NS4 (c200) a Core (c22).
PRINCIP POSTUPU
Membrána testovacího zařízení je potažena HCV antigenem v testovací oblasti a kozí anti králičí IgG protilátkou v kontrolní oblasti.Štítkové polštářky jsou předem potaženy fluorescenčně značeným HCV antigenem a králičím IgG.Při testování pozitivního vzorku se HCV protilátka ve vzorku spojí s fluorescenčně značeným HCV antigenem a vytvoří imunitní směs.Působením imunochromatografie komplex proudí ve směru absorpčního papíru, když komplex prošel testovací oblastí, spojil se s antigenem potahujícím HCV antigenem, vytvořil nový komplex. Hladina protilátek HCV pozitivně koreluje s fluorescenčním signálem a koncentrací Protilátku HCV ve vzorku lze detekovat fluorescenční imunoanalýzou
DODÁVANÉ REAGENCIE A MATERIÁLY
Součásti balení 25T:
.Testovací karta jednotlivě fólie s vysoušedlem
.Ředidla vzorků
.Příbalový leták
MATERIÁLY POTŘEBNÉ, ALE NEDODÁVANÉ
Nádoba na odběr vzorků, časovač
ODBĚR A SKLADOVÁNÍ VZORKŮ
1. Testovanými vzorky může být sérum, heparinová antikoagulační plazma nebo EDTA antikoagulační plazma.
2.Podle standardních technik odeberte vzorek.Vzorek séra nebo plazmy lze uchovávat v chladničce při 2-8 °C po dobu 7 dnů a kryokonzervovat pod -15 °C po dobu 6 měsíců
3. Všechny vzorky se vyvarují cyklů zmrazování a rozmrazování.
POSTUP TESTU
Před testováním si přečtěte návod k obsluze přístroje a příbalový leták.
.Tento výsledek testu je pouze pro klinickou referenci, neměl by sloužit jako jediný základ pro klinickou diagnózu a léčbu, klinický management pacienta by měl být komplexní zvážení v kombinaci s jeho symptomy, anamnézou, dalším laboratorním vyšetřením, léčebnou odpovědí, epidemiologií a dalšími informacemi .
.Toto činidlo se používá pouze pro testy séra a plazmy.Při použití pro jiné vzorky, jako jsou sliny a moč atd., nemusí získat přesné výsledky.
VÝKONOVÉ CHARAKTERISTIKY
| Linearita | 0,005-5 | relativní odchylka: -15 % až +15 %. |
| Lineární korelační koeficient:(r)≥0,9900 | ||
| Přesnost | Míra návratnosti se musí pohybovat v rozmezí 85 % – 115 %. | |
| Opakovatelnost | CV≤15 % | |
REFERENCE
1.Potransfuzní hepatitida.In: Moore SB, ed.Virové choroby přenášené transfuzí.Alington, VA.Dopoledne.Doc.Krevní banky, s. 53-38.
2.Hansen JH, et al. HAMA Interference s myšími monoklonálními protilátkovými imunoanalýzami [J]. J of Clin Immunoassay, 1993, 16: 294-299.
3.Levinson SS. Povaha heterofilních protilátek a role v interferenci imunotestů [J]. J of Clin Immunoassay, 1992, 15:108-114.
4. Alter HJ., Purcell RH, Holland PV, et al.(1978) Přenosný agens u non-A, non-B hepatitidy.Lanceta I: 459-463.
5. Choo QL, Weiner AJ, Overby LR, Kuo G, Houghton M. (1990) Virus hepatitidy C: hlavní původce virové hepatitidy non-A, non-B.Br Med Bull 46: 423-441.
6. Engvall E, Perlmann P. (1971) Enzyme linked immunosorbent assay (ELISA): kvalitativní test IgG.Immunochemistry 8:871-874.
OČEKÁVANÉ HODNOTY
HCV-Ab<0,02
Doporučuje se, aby si každá laboratoř stanovila svůj vlastní normální rozsah reprezentující populaci pacientů.
VÝSLEDKY TESTU A INTERPRETACE
- Výše uvedená data jsou výsledkem testu na HCV-Ab a doporučuje se, aby každá laboratoř stanovila rozsah detekčních hodnot HCV-Ab vhodný pro populaci v této oblasti.Výše uvedené výsledky jsou pouze orientační.
- Výsledky této metody jsou použitelné pouze pro referenční rozsahy stanovené v této metodě a neexistuje žádná přímá srovnatelnost s jinými metodami.
- Další faktory mohou také způsobit chyby ve výsledcích detekce, včetně technických důvodů, provozních chyb a dalších faktorů vzorku.
SKLADOVÁNÍ A STABILITA
- Skladovatelnost sady je 18 měsíců od data výroby.Nepoužité soupravy skladujte při 2-30°C.NEZMRZŇUJTE.Nepoužívejte po uplynutí doby použitelnosti.
- Neotevírejte zapečetěný sáček, dokud nejste připraveni provést test, a jednorázový test se doporučuje použít v požadovaném prostředí (teplota 2-35 °C, vlhkost 40-90 %) do 60 minut co nejrychleji. .
- Rozpouštědlo vzorků se použije ihned po otevření.
VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ
.Souprava by měla být utěsněna a chráněna před vlhkostí.
.Všechny pozitivní vzorky musí být validovány jinými metodikami.
.Se všemi vzorky se musí zacházet jako s potenciálními znečišťujícími látkami.
.NEPOUŽÍVEJTE reagencie s prošlou dobou použitelnosti.
.NEZAMĚŇUJTE reagencie mezi soupravami s odlišným číslem šarže.
.NEPOUŽÍVEJTE opakovaně testovací karty a jakékoli jednorázové příslušenství.
.Nesprávná obsluha, nadměrný nebo malý vzorek mohou vést k odchylkám ve výsledku.
LIMITACE
.Stejně jako u každého testu využívajícího myší protilátky existuje možnost interference s lidskými anti-myšími protilátkami (HAMA) ve vzorku.Vzorky od pacientů, kteří dostali preparáty monoklonálních protilátek pro diagnostiku nebo terapii, mohou obsahovat HAMA.Takové vzorky mohou způsobit falešně pozitivní nebo falešně negativní výsledky.
Klíč k použitým symbolům:
 | Diagnostický lékařský přístroj in vitro |
 | Výrobce |
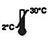 | Skladujte při 2-30 ℃ |
 | Datum spotřeby |
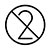 | Nepoužívejte znovu |
 | POZOR |
 | Přečtěte si návod k použití |
















