Diagnosekit für Hepatitis-C-Virus-Antikörper (Fluoreszenz-Immunchromatographie-Assay)
Nur für die In-vitro-Diagnostik
Bitte lesen Sie diese Packungsbeilage vor der Anwendung sorgfältig durch und befolgen Sie die Anweisungen genau.Bei Abweichungen von den Anweisungen in dieser Packungsbeilage kann die Zuverlässigkeit der Testergebnisse nicht garantiert werden.
VERWENDUNGSZWECK
Das Diagnosekit für Hepatitis-C-Virus-Antikörper (Fluoreszenz-Immunchromatographie-Assay) ist ein Fluoreszenz-Immunchromatographie-Assay für den quantitativen Nachweis von HCV-Antikörpern in menschlichem Serum oder Plasma, der einen wichtigen zusätzlichen diagnostischen Wert für eine Infektion mit Hepatitis C darstellt. Alle positiven Proben müssen durch andere bestätigt werden Methoden.Dieser Test ist nur für die Verwendung durch medizinisches Fachpersonal bestimmt
1. Alle Reagenzien und Proben bei Raumtemperatur aufbewahren.
2.Öffnen Sie den tragbaren Immunanalysator (WIZ-A101), geben Sie das Kontopasswort ein, melden Sie sich entsprechend der Betriebsmethode des Instruments an und rufen Sie die Erkennungsschnittstelle auf.
3.Scannen Sie den Identifikationscode, um den Testgegenstand zu bestätigen.
4. Nehmen Sie die Testkarte aus dem Folienbeutel.
5. Stecken Sie die Testkarte in den Kartensteckplatz, scannen Sie den QR-Code und ermitteln Sie den Testgegenstand.
6. 20 μl Serum- oder Plasmaprobe zum Probenverdünnungsmittel hinzufügen und gut mischen.
7. Geben Sie 80 μl Probenlösung in die Probenvertiefung der Karte.
8.Klicken Sie auf die Schaltfläche „Standardtest“. Nach 15 Minuten erkennt das Gerät automatisch die Testkarte, kann die Ergebnisse auf dem Display des Geräts ablesen und die Testergebnisse aufzeichnen/ausdrucken.
9. Beachten Sie die Anleitung des tragbaren Immunanalysators (WIZ-A101).
ZUSAMMENFASSUNG
Das Hepatitis-C-Virus (HCV) ist ein umhülltes, einzelsträngiges Positiv-Sense-RNA-Virus (9,5 kb), das zur Familie der Flaviviridae gehört.Es wurden sechs Hauptgenotypen und eine Reihe von Subtypen von HCV identifiziert.HCV wurde 1989 isoliert und gilt heute als Hauptursache für transfusionsbedingte Non-A- und Non-B-Hepatitis.Die Krankheit ist durch eine akute und chronische Form gekennzeichnet.Mehr als 50 % der Infizierten entwickeln eine schwere, lebensbedrohliche chronische Hepatitis mit Leberzirrhose und hepatozellulären Karzinomen.Seit der Einführung des Anti-HCV-Screenings bei Blutspenden im Jahr 1990 ist die Inzidenz dieser Infektion bei Transfusionsempfängern deutlich zurückgegangen.Klinische Studien zeigen, dass eine beträchtliche Anzahl HCV-infizierter Personen Antikörper gegen das nichtstrukturelle Protein NS5 des Virus entwickeln.Dabei umfassen die Tests neben NS3 (c200), NS4 (c200) und dem Core (c22) auch Antigene aus der NS5-Region des viralen Genoms.
PRINZIP DES VERFAHRENS
Die Membran des Testgeräts ist im Testbereich mit HCV-Antigen und im Kontrollbereich mit Ziegen-Anti-Kaninchen-IgG-Antikörper beschichtet.Die Etikettenblöcke werden vorab mit fluoreszenzmarkiertem HCV-Antigen und Kaninchen-IgG beschichtet.Beim Testen einer positiven Probe verbinden sich die HCV-Antikörper in der Probe mit dem fluoreszenzmarkierten HCV-Antigen und bilden eine Immunmischung.Unter der Wirkung der Immunchromatographie fließt der Komplex in Richtung des saugfähigen Papiers. Wenn der Komplex den Testbereich passiert, verbindet er sich mit dem HCV-Antigen-Beschichtungsantigen und bildet einen neuen Komplex. Der HCV-Antikörperspiegel korreliert positiv mit dem Fluoreszenzsignal und der Konzentration von HCV-Antikörper in der Probe können durch einen Fluoreszenz-Immunoassay nachgewiesen werden
MITGELIEFERTE REAGENZIEN UND MATERIALIEN
25T-Paketkomponenten::
.Testkarten einzeln in Folie verpackt mit Trockenmittel
.Probenverdünnungsmittel
.Packungsbeilage
ERFORDERLICHE, ABER NICHT ZUR VERFÜGUNG GESTELLTE MATERIALIEN
Probensammelbehälter, Timer
PROBENSAMMLUNG UND LAGERUNG
1. Bei den getesteten Proben kann es sich um Serum, Heparin-Antikoagulans-Plasma oder EDTA-Antikoagulans-Plasma handeln.
2.Entnehmen Sie gemäß den Standardtechniken eine Probe.Serum- oder Plasmaproben können 7 Tage lang bei 2–8 °C gekühlt und 6 Monate lang bei unter -15 °C kryokonserviert werden
3. Vermeiden Sie bei allen Proben Gefrier-Tau-Zyklen.
TESTVERFAHREN
Bitte lesen Sie vor dem Test die Bedienungsanleitung und die Packungsbeilage des Geräts.
Dieses Testergebnis dient nur als klinische Referenz und sollte nicht als einzige Grundlage für die klinische Diagnose und Behandlung dienen. Das klinische Management des Patienten sollte umfassend berücksichtigt werden, kombiniert mit seinen Symptomen, seiner Krankengeschichte, anderen Laboruntersuchungen, dem Ansprechen auf die Behandlung, der Epidemiologie und anderen Informationen .
.Dieses Reagenz wird nur für Serum- und Plasmatests verwendet.Bei Verwendung anderer Proben wie Speichel, Urin usw. werden möglicherweise keine genauen Ergebnisse erzielt.
LEISTUNGSMERKMALE
| Linearität | 0,005-5 | relative Abweichung: -15 % bis +15 %. |
| Linearer Korrelationskoeffizient: (r)≥0,9900 | ||
| Genauigkeit | Die Wiederherstellungsrate muss zwischen 85 % und 115 % liegen. | |
| Wiederholbarkeit | CV≤15 % | |
VERWEISE
1. Hepatitis nach Transfusion.In: Moore SB, Hrsg.Durch Transfusionen übertragene Viruserkrankungen.Alington, VA.Bin.Assoc.Blutbanken, S. 53-38.
2. Hansen JH, et al. HAMA-Interferenz mit murinen monoklonalen Antikörper-basierten Immunoassays[J].J of Clin Immunoassay, 1993, 16:294-299.
3.Levinson SS.Die Natur heterophiler Antikörper und die Rolle bei Immunoassay-Interferenzen[J].J of Clin Immunoassay,1992,15:108-114.
4.Alter HJ., Purcell RH, Holland PV, et al.(1978) Übertragbarer Erreger bei Nicht-A- und Nicht-B-Hepatitis.Lanzette I: 459-463.
5.Choo QL, Weiner AJ, Overby LR, Kuo G, Houghton M. (1990) Hepatitis-C-Virus: der Hauptverursacher der viralen Non-A-, Non-B-Hepatitis.Br Med Bull 46: 423-441.
6. Engvall E, Perlmann P. (1971) Enzyme Linked Immunosorbent Assay (ELISA): qualitativer Assay von IgG.Immunchemie 8:871-874.
ERWARTETE WERTE
HCV-Ab<0,02
Es wird empfohlen, dass jedes Labor seinen eigenen Normalbereich ermittelt, der seine Patientenpopulation repräsentiert.
TESTERGEBNISSE UND INTERPRETATION
- Die oben genannten Daten sind das Ergebnis eines HCV-Ab-Reagenztests und es wird empfohlen, dass jedes Labor einen Bereich von HCV-Ab-Nachweiswerten festlegen sollte, der für die Bevölkerung in dieser Region geeignet ist.Die obigen Ergebnisse dienen nur als Referenz.
- Die Ergebnisse dieser Methode sind nur auf die in dieser Methode ermittelten Referenzbereiche anwendbar und es besteht keine direkte Vergleichbarkeit mit anderen Methoden.
- Andere Faktoren können ebenfalls zu Fehlern in den Erkennungsergebnissen führen, darunter technische Gründe, Betriebsfehler und andere Stichprobenfaktoren.
LAGERUNG UND STABILITÄT
- Das Kit ist ab Herstellungsdatum 18 Monate haltbar.Lagern Sie die unbenutzten Kits bei 2–30 °C.NICHT EINFRIEREN.Nicht nach Ablauf des Verfallsdatums verwenden.
- Öffnen Sie den versiegelten Beutel erst, wenn Sie bereit sind, einen Test durchzuführen. Es wird empfohlen, den Einwegtest so schnell wie möglich innerhalb der erforderlichen Umgebung (Temperatur 2–35 °C, Luftfeuchtigkeit 40–90 %) innerhalb von 60 Minuten zu verwenden .
- Der Probenverdünner wird unmittelbar nach dem Öffnen verwendet.
WARNUNGEN UND VORSICHTSMASSNAHMEN
.Das Kit sollte versiegelt und vor Feuchtigkeit geschützt werden.
.Alle positiven Proben müssen mit anderen Methoden validiert werden.
.Alle Proben sind als potenzieller Schadstoff zu behandeln.
.Verwenden Sie KEIN abgelaufenes Reagenz.
.Tauschen Sie Reagenzien NICHT zwischen Kits mit unterschiedlichen Chargennummern aus.
.Testkarten und Einwegzubehör NICHT wiederverwenden.
.Fehlbedienung, zu große oder geringe Probenmenge kann zu Ergebnisabweichungen führen.
LNACHAHMUNG
.Wie bei jedem Assay mit Maus-Antikörpern besteht die Möglichkeit einer Störung der Probe durch menschliche Anti-Maus-Antikörper (HAMA).Proben von Patienten, die zu Diagnose- oder Therapiezwecken monoklonale Antikörperpräparate erhalten haben, können HAMA enthalten.Solche Proben können zu falsch positiven oder falsch negativen Ergebnissen führen.
Legende zu den verwendeten Symbolen:
 | Medizinisches Gerät für die In-vitro-Diagnostik |
 | Hersteller |
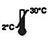 | Bei 2-30℃ lagern |
 | Verfallsdatum |
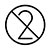 | Nicht wiederverwenden |
 | VORSICHT |
 | Gebrauchsanweisung beachten |
















