Diagnostiskt kit för antikropp mot hepatit C-virus (fluorescensimmunokromatografisk analys)
Endast för in vitro-diagnostik
Läs denna bipacksedel noggrant före användning och följ instruktionerna strikt.Tillförlitligheten hos analysresultaten kan inte garanteras om det finns några avvikelser från instruktionerna i denna bipacksedel.
AVSEDD ANVÄNDNING
Diagnostiskt kit för hepatit C-virusantikropp (fluorescensimmunokromatografisk analys) är en fluorescensimmunokromatografisk analys för kvantitativ detektering av HCV-antikroppar i humant serum eller plasma, vilket är ett viktigt diagnostiskt hjälpvärde för infektion med hepatit C. Alla positiva prov måste bekräftas av andra metoder.Detta test är endast avsett för sjukvårdspersonal
1. Lägg undan alla reagenser och prover till rumstemperatur.
2.Öppna Portable Immune Analyzer (WIZ-A101), ange kontolösenordsinloggningen enligt instrumentets funktionsmetod och gå in i detektionsgränssnittet.
3. Skanna dentifieringskoden för att bekräfta testobjektet.
4.Ta ut testkortet ur foliepåsen.
5. Sätt i testkortet i kortplatsen, skanna QR-koden och bestäm testobjektet.
6. Tillsätt 20 μL serum- eller plasmaprov till provspädningsvätskan och blanda väl.
7. Tillsätt 80 μL provlösning till provbrunnen på kortet.
8.Klicka på knappen "standardtest", efter 15 minuter kommer instrumentet automatiskt att upptäcka testkortet, det kan läsa resultaten från instrumentets display och spela in/skriva ut testresultaten.
9. Se instruktionerna för Portable Immune Analyzer (WIZ-A101).
SAMMANFATTNING
Hepatit C-virus (HCV) är ett envelope, enkelsträngat positivt sense RNA (9,5 kb) virus som tillhör familjen Flaviviridae.Sex stora genotyper och serier av subtyper av HCV har identifierats.Isolerad 1989 är HCV nu erkänd som den huvudsakliga orsaken till transfusionsassocierad icke-A, icke-B hepatit.Sjukdomen kännetecknas av akut och kronisk form.Mer än 50 % av de infekterade individerna utvecklar allvarlig, livshotande kronisk hepatit med levercirros och hepatocellulära karcinom.Sedan införandet 1990 av anti-HCV-screening av bloddonationer har förekomsten av denna infektion hos transfusionsmottagare minskat avsevärt.Kliniska studier visar att en betydande mängd HCV-infekterade individer utvecklar antikroppar mot NS5 icke-strukturellt protein av viruset.För detta inkluderar testerna antigener från NS5-regionen i det virala genomet förutom NS3 (c200), NS4 (c200) och Core (c22).
PRINCIP FÖR FÖRFARANDET
Membranet på testanordningen är belagt med HCV-antigen på testområdet och get-anti-kanin-IgG-antikropp på kontrollområdet.Etikettdyna är belagd med fluorescensmärkt HCV-antigen och kanin-IgG i förväg.Vid testning av positivt prov kombineras HCV-antikroppen i provet med fluorescensmärkt HCV-antigen och bildar en immunblandning.Under verkan av immunokromatografin, flödet av komplexet i riktning mot absorberande papper, när komplexet passerade testområdet, det kombinerat med HCV-antigenbeläggningsantigen, bildar ett nytt komplex. HCV-antikroppsnivån är positivt korrelerad med fluorescenssignalen och koncentrationen av HCV-antikroppar i provet kan detekteras genom fluorescensimmunanalys
REAGENSER OCH MATERIAL MEDFÖLJER
25T paketkomponenter:
.Testkort individuellt folie förpackade med ett torkmedel
. Provspädningsmedel
.Bipacksedel
MATERIAL KRÄVS MEN EJ TILLHANDAHÅLLS
Provsamlingsbehållare, timer
PROVINSAMLING OCH FÖRVARING
1. Proverna som testas kan vara serum, heparinantikoagulantplasma eller EDTA-antikoagulantplasma.
2. Samla prov enligt standardtekniker.Serum- eller plasmaprov kan förvaras i kyl vid 2-8 ℃ i 7 dagar och kryokonservering under -15 °C i 6 månader
3. Alla prover undviker frys-upptiningscykler.
ANALYSPROCEDUR
Läs instrumentets bruksanvisning och bipacksedel innan du testar.
.Detta testresultat är endast för klinisk referens, bör inte tjäna som den enda grunden för klinisk diagnos och behandling, patientens kliniska hantering bör vara omfattande övervägande i kombination med dess symtom, medicinsk historia, annan laboratorieundersökning, behandlingssvar, epidemiologi och annan information .
.Detta reagens används endast för serum- och plasmatester.Det kanske inte får exakta resultat när det används för andra prover som saliv och urin och etc.
PRESTANDA KARAKTERISTIKA
| Linjäritet | 0,005-5 | relativ avvikelse:-15% till +15%. |
| Linjär korrelationskoefficient:(r)≥0,9900 | ||
| Noggrannhet | Återvinningsgraden ska ligga inom 85 % – 115 %. | |
| Repeterbarhet | CV≤15 % | |
REFERENSER
1.Hepatit efter transfusion.I: Moore SB, red.Transfusionsöverförda virussjukdomar.Alington, VA.Am.Assoc.Blodbanker, s. 53-38.
2. Hansen JH, et al. HAMA Interference with Murine Monoclonal Antibody-Based Immunoassays[J].J of Clin Immunoassay, 1993,16:294-299.
3. Levinson SS. Naturen av heterofila antikroppar och rollen i immunanalysinterferens[J].J av Clin Immunoassay, 1992, 15:108-114.
4. Alter HJ., Purcell RH, Holland PV, et al.(1978) Överförbart agens vid icke-A, icke-B hepatit.Lancet I: 459-463.
5. Choo QL, Weiner AJ, Overby LR, Kuo G, Houghton M. (1990) Hepatit C-virus: den huvudsakliga orsaken till viral non-A, non-B hepatit.Br Med Bull 46: 423-441.
6. Engvall E, Perlmann P. (1971) Enzyme linked immunosorbent assay (ELISA): kvalitativ analys av IgG.Immunochemistry 8:871-874.
FÖRVÄNTADE VÄRDEN
HCV-Ab <0,02
Det rekommenderas att varje laboratorium upprättar sitt eget normalintervall som representerar patientpopulationen.
TESTRESULTAT OCH TOLKNING
- Ovanstående data är resultatet av HCV-Ab-reagenstest, och det föreslås att varje laboratorium bör fastställa ett intervall av HCV-Ab-detektionsvärden som är lämpliga för befolkningen i denna region.Ovanstående resultat är endast för referens.
- Resultaten av denna metod är endast tillämpliga på de referensintervall som fastställts i denna metod, och det finns ingen direkt jämförbarhet med andra metoder.
- Andra faktorer kan också orsaka fel i detekteringsresultaten, inklusive tekniska orsaker, driftsfel och andra provfaktorer.
FÖRVARING OCH STABILITET
- Satsen är 18 månaders hållbarhet från tillverkningsdatum.Förvara oanvända kit vid 2-30°C.FRYS INTE.Använd inte efter utgångsdatum.
- Öppna inte den förseglade påsen förrän du är redo att utföra ett test, och engångstestet rekommenderas att användas i den miljö som krävs (temperatur 2-35 ℃, luftfuktighet 40-90 %) inom 60 minuter så snabbt som möjligt .
- Provspädningsmedel används omedelbart efter att det öppnats.
VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER
.Satsen ska vara förseglad och skyddad mot fukt.
.Alla positiva prover ska valideras med andra metoder.
.Alla prover ska behandlas som potentiella föroreningar.
.ANVÄND INTE utgånget reagens.
.Byt INTE reagens mellan kit med olika lotnr.
.Återanvänd INTE testkort och eventuella engångstillbehör.
.Feloperation, för stort eller litet prov kan leda till resultatavvikelser.
LIMITATION
.Som med alla analyser som använder musantikroppar, finns möjligheten för interferens av humana antimusantikroppar (HAMA) i provet.Prover från patienter som har fått preparat av monoklonala antikroppar för diagnos eller terapi kan innehålla HAMA.Sådana prover kan orsaka falskt positiva eller falskt negativa resultat.
Nyckel till använda symboler:
 | In vitro diagnostisk medicinsk anordning |
 | Tillverkare |
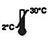 | Förvara vid 2-30 ℃ |
 | Utgångsdatum |
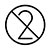 | Återanvänd inte |
 | VARNING |
 | Se bruksanvisningen |
















